NGHIÊN CỨU TẠO MÔ SẸO VÀ HUYỀN PHÙ TẾ BÀO LOÀI DÓ VÂN NAM (AQUILARIA YUNNANENSIS) VÀ DÓ QUẢ NHĂN (AQUILAIRA RUGOSA)
Trường Đại học Lâm nghiệp
Xuân Mai, Hà Nội
Số điện thoại: 0973954911; Email: thont@vnuf.edu.vn
Nội dung chính của bài viết
Tóm tắt (Abstract)
Dó vân nam và Dó quả nhăn thuộc họ Thymelaeaceae, có giá trị kinh tế cao nhưng đang bị đe dọa ngoài tự nhiên. Nghiên cứu này được tiến hành nhằm thiết lập quy trình nuôi cấy mô sẹo và huyền phù tế bào hai loài Dó trên. Vật liệu nuôi cấy là lá của cây mầm in vitro hai tháng tuổi. 2,4-Dichlorophenoxyacetic (2,4-D) ở nồng độ 0-4 mg/L được sử dụng riêng lẻ hoặc kết hợp với 0,5-1,5 mg/L 6-benzylaminopurine (BAP) hoặc 0,2-0,8 mg/L Thidiazuron (TDZ) để đánh giá khả năng cảm ứng và nhân sinh khối mô sẹo. Hai loại đường glucose và sucrose với hàm lượng 30-50 g/L được dùng cho nuôi cấy huyền phù tế bào. Kết quả cho thấy, sự kết hợp giữa 2,4-D với BAP hoặc TDZ cho hiệu quả cảm ứng mô sẹo tốt hơn 2,4-D riêng lẻ. Môi trường Murashige and Skoog (MS) có chứa 3 mg/L 2,4-D + 0,8 mg/L TDZ là thích hợp nhất để cảm ứng mô sẹo hai loài Dó. Mô sẹo tiếp tục được nhân nuôi và sinh trưởng tốt trên môi trường có bổ sung 2 mg/L 2,4-D với 0,8 mg/L TDZ (Dó vân nam) hoặc với 0,6 mg/L TDZ (Dó quả nhăn). Sự kết hợp giữa glucose và sucrose cho hiệu quả tốt hơn đối với huyền phù tế bào so với sử dụng hai loại đường đơn lẻ. Môi trường tối ưu cho nuôi cấy huyền phù tế bào hai loài Dó là MS có bổ sung 20 g/L glucose, 20 g/L sucrose, 2 mg/L 2,4-D và 0,8 mg/L TDZ. Kết quả này có thể làm cơ sở cho những nghiên cứu tạo tinh dầu trầm in vitro từ nuôi cấy tế bào hai loài Dó vân nam và Dó quả nhăn.
Abstract
RESEARCH ON THE CULTURE OF CALLUS AND CELL SUSPENSION OF AQUILARIA YUNNANENSIS AND AQUILARIA RUGOSA.
Aquilaria yunnanensis and A. rugosa are two economically valuable species within the Thymelaeaceae family that are currently threatened in their natural habitats. This study was conducted to determine optimal conditions for callus induction and cell suspension culture for both species. Leaves from in vitro 2 -month -old seedlings were used as explants for callus induction. 2,4-Dichlorophenoxyacetic (2.4‑D) at 0-4 mg/L was applied individually or in combination with 0.5-1.5 mg/L 6-benzylaminopurine (BAP) or 0.2-0.8 mg/L Thidiazuron (TDZ) to evaluate callus induction efficiency and multiplication. Glucose and sucrose at 30-50 g/L were used to test their effects on cell suspension culture. Results demonstrated that combinations of 2.4‑D with either BAP or TDZ yielded superior callus induction compared to 2.4‑D alone. The most effective medium for callus formation in both A. yunnanensis and A. rugosa was Murashige & Skoog (MS) supplemented with 3 mg/L 2.4‑D + 0.8 mg/L TDZ. The callus was subsequently propagated and exhibited robust growth on medium containing 2 mg/L 2.4‑D + 0.8 mg/L TDZ for A. yunnanensis, and 2 mg/L 2,4‑D + 0.6 mg/L TDZ for A. rugosa. Mixed carbon sources (20 g/L glucose + 20 g/L sucrose) significantly outperformed single sugar sources in s upporting cell suspension culture. The optimal medium for suspension culture of both species was MS supplemented with 20 g/L glucose + 20 g/L sucrose + 2 mg/L 2,4‑D and 0.8 mg/L TDZ. These findings may provide a foundational protocol for research on the production of in vitro agarwood essential oil from cell culture in A. yunnanensis and A. rugosa.
Từ khóa (Keywords)
Dó vân nam, Dó quả nhăn, mô sẹo, huyền phù tế bào, 2, 4-D, TDZ
Chi tiết bài viết

Bài báo này được cấp phép theo Creative Commons Attribution 4.0 International License.
- Điểm nổi bật:
Đây là những kết quả nghiên cứu đầu tiên về tạo mô sẹo và huyền phù tế bào Dó vân nam (Aquilaria yunnanensis) ở Việt Nam.
Đánh giá được ảnh hưởng của 2,4-D phối hợp với BAP và TDZ lên khả năng tạo mô Dó quả nhăn (Aquilaria rugosa) ở Việt Nam.
Đánh giá được mức độ ảnh hưởng của đường glucose và sự phối hợp giữa glucose với sucrose đến nuôi cấy huyền phù tế bào Dó quả nhăn.
1. ĐẶT VẤN ĐỀ
Dó vân nam (A. yunnanensis) là một loài đặc hữu của Trung Quốc, có khả năng tạo trầm quý có giá trị kinh tế và dược liệu cao, hiện đang bị đe dọa và được liệt kê trong Sách Đỏ IUCN [1, 2]. Dó vân nam là loài mới được ghi nhận ở Việt Nam, vào năm 2019 trong các khu rừng tự nhiên tại Khu Bảo tồn Thiên nhiên Đồng Sơn Kỳ Thượng tỉnh Quảng Ninh ở độ cao từ 400 đến 480 m với số ít cá thể trưởng thành [3]. Dó quả nhăn (A. rugosa) lần đầu tiên được phát hiện tại huyện Sa Thầy, tỉnh Kontum vào năm 2005 [4]. Loài có nguy cơ tuyệt chủng ngoài tự nhiên do số lượng cá thể ít, môi trường sống bị xâm phạm. Tuy nhiên, những năm gần đây Dó quả nhăn đã được gây trồng tại một số hộ gia đình ở tỉnh Kontum. Chúng có khả năng tạo trầm với mùi thơm đặc trưng, thường được gọi là trầm hương núi [5].
Các loài thuộc chi Aquilaria nói chung và hai loài Dó vân nam và Dó quả nhăn nói riêng nổi tiếng về khả năng tạo trầm hương (Agarwood) là sản phẩm lâm sản ngoài gỗ có giá trị kinh tế cao. Trầm hương thường được sinh ra trong phần gỗ tại những nơi cây bị tổn thương [6, 7], nó gồm tập hợp của nhiều hợp chất thứ cấp có hoạt tính sinh học cao có giá trị trong y học. Ngoài ra, trầm hương còn được sử dụng làm nguyên liệu cho ngành công nghiệp nước hoa, lĩnh vực tôn giáo ở nhiều nước trên thế giới [8]. Chính vì giá trị cao, nên các loài Aquilaria ở Việt Nam đã và đang bị khai thác quá mức để tìm kiếm trầm hương, dẫn đến chúng có nguy cơ tuyệt chủng ngoài tự nhiên.
Hiện nay, với sự phát triển vượt bậc của công nghệ sinh học, việc sản xuất các sản phẩm thứ cấp của cây nhờ nuôi cấy sinh khối mô sẹo/tế bào hoặc nuôi cấy cơ quan đã được thực hiện thành công ở nhiều loài thực vật [9, 10]. Nuôi cấy mô sẹo có thể mang lại nhiều giá trị như cung cấp vật liệu cho việc nuôi cấy huyền phù tế bào hoặc tế bào đơn, nghiên cứu cấu tạo hình thái và sinh lý, tạo ra các dòng tế bào soma có giá trị cũng như tổng hợp các hợp chất thứ cấp [11, 12]. Đối với chi Aquilaria, nghiên cứu nuôi cấy mô sẹo, huyền phù tế bào hay rễ bất định đã được nghiên cứu thành công ở một số loài như A. crassna, A. malaccensis, A. sinensis, A. agallocha, A. rugosa và bước đầu có ứng dụng trong việc tổng hợp các sản phẩm thứ cấp từ huyền phù tế bào [2, 5, 11-24]. Khả năng tạo mô sẹo và huyền phù tế bào của các loài là rất khác nhau, nên việc nghiên cứu tạo mô sẹo, huyền phù tế bào cho loài Dó vân nam và Dó quả nhăn là rất cần thiết. Vì vậy, mục đích của nghiên cứu này là thiết lập một điều kiện nuôi cấy mô sẹo và huyền phù tế bào hiệu quả góp phần tạo cơ sở cho những nghiên cứu tăng cường tổng hợp các hợp chất thứ cấp ở các loài Dó vân nam và Dó quả nhăn in vitro.
2. VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Vật liệu
Hạt của loài Dó vân nam và Dó quả nhăn được thu nhận lần lượt tại Quảng Ninh và Kontum vào tháng 6 năm 2022 được gieo trong môi trường Murashige and Skoog (MS) có bổ sung 20 g/L sucrose, 7 g/L agar. Những lá khỏe mạnh của cây mầm 2 tháng tuổi được sử dụng làm vật liệu cảm ứng mô sẹo.
Môi trường nuôi cấy: Môi trường MS là môi trường nuôi cấy cơ bản. MS và các chất điều hòa sinh trưởng sử dụng trong nghiên cứu được mua từ hãng Duchefa Biochemie (Netherlands). Tất cả các môi trường nuôi cấy được chỉnh pH = 5,7±0,1 và được khử trùng ở 121oC trong 20 phút.
2.2. Phương pháp nghiên cứu
Cảm ứng và nhân nhanh mô sẹo
Ảnh hưởng của chất điều hòa sinh trưởng đến khả năng cảm ứng mô sẹo
Chất điều hòa sinh trưởng 2,4-D (0-4 mg/L) riêng lẻ hoặc kết hợp với BAP (0,5-1,5 mg/L) hoặc TDZ (0,2-0,8 mg/L) được bổ sung vào môi trường MS chứa 30 g/L sucrose, 7g/L agar được sử dụng để đánh giá khả năng cảm ứng mô sẹo từ lá in vitro của hai loài Dó vân nam và Dó quả nhăn. Các mảnh lá có kích thước khoảng 1 cm2 được đặt vào các môi trường thí nghiệm, tỷ lệ % mẫu tạo mô sẹo, trọng lượng tươi mô sẹo/mẫu và đặc điểm của mô sẹo được ghi nhận sau 8 tuần nuôi cấy.
Ảnh hưởng của chất điều hòa sinh trưởng đến khả năng nhân nhanh mô sẹo
Các khối mô sẹo của hai loài Dó vân nam và Dó quả nhăn có kích thước f 0,3 cm hình thành từ môi trường cảm ứng mô sẹo trên được cấy chuyển sang môi trường nhân nhanh mô sẹo. Môi trường thí nghiệm gồm MS có chứa 2,4-D từ 2-3 mg/L kết hợp với BAP có nồng độ 0,5-1,5 mg/L hoặc TDZ ở nồng độ 0,2-0,8 mg/L, 30 g/L sucrose và 7 g/L agar. Kết quả được đánh giá sau 8 tuần nuôi cấy thông qua các tiêu chí khối lượng tươi mô sẹo/mẫu, khối lượng khô mô sẹo, chỉ số sinh trưởng mô sẹo và đặc điểm của mô sẹo.
Tạo huyền phù tế bào Dó vân nam và Dó quả nhăn
Ảnh hưởng của chất điều hòa sinh trưởng đến khả năng tạo huyền phù tế bào
Các chất điều hòa sinh trưởng 2,4-D, IAA, IBA và NAA ở nồng độ 2 mg/L lần lượt kết hợp với 0,8 mg/L TDZ được dùng để đánh giá khả năng tạo huyền phù Dó vân nam và Dó quả nhăn. Các tổ hợp chất điều hoà sinh trưởng được bổ sung vào môi trường MS có chứa 40 g/L sucrose. Lượng mô sẹo ban đầu được sử dụng cho việc hình thành huyền phù là 2 g mô sẹo xốp. Mô sẹo được nuôi trong các bình tam giác 250 ml có chứa 100 ml dung dịch môi trường, trong điều kiện tối ở nhiệt độ 26 ± 2ºC với chế độ lắc 100 vòng/phút. Kết quả được đánh giá ở ngày thứ 20 dựa trên các chỉ tiêu về khối lượng tươi, khối lượng khô, chỉ số sinh trưởng (GI) và đặc điểm của huyền phù tế bào. Tế bào được thu nhận bằng cách lọc dịch huyền phù tế bào qua giấy lọc Whatman số 1 và đem cân để có khối lượng tươi. Khối lượng khô của mô sẹo được xác định bằng cách: toàn bộ sinh khối tươi được sấy ở 500C sau 48 giờ. GI =(Wf-Wi)/Wi. Trong đó: Wf là khối lượng tươi cuối cùng tại thời điểm thu hoạch, Wi là khối lượng tế bào nuôi cấy ban đầu.
Ảnh hưởng của glucose và sucrose đến huyền phù tế bào
Môi trường MS có chứa tổ hợp chất điều hoà sinh trưởng thích hợp nhất ở thí nghiệm trên gồm 2 mg/L 2,4-D kết hợp với 0,8 mg/L TDZ và được bổ sung thêm 30-50 g/L đường sucrose hoặc 30 - 50 g/L glucose được sử dụng để đánh giá ảnh hưởng của hàm lượng và loại đường đến khả năng sinh trưởng của tế bào A. yunnanensis và A. rugosa. Vật liệu nuôi cấy ban đầu là 2 g mô sẹo xốp. Kết quả thí nghiệm được ghi nhận sau 20 ngày nuôi cấy qua các tiêu chí khối lượng tươi, khối lượng khô, chỉ số sinh trưởng và đặc điểm của tế bào huyền phù.
Các thí nghiệm được nuôi trong điều kiện thiếu ánh sáng ở 26 ± 1oC.
Thu thập và xử lý số liệu
Tất cả các thí nghiệm được thực hiện lặp lại 3 lần, mỗi lần 30 mẫu. Kết quả thí nghiệm được phân tích Ducan’s test bằng phần mềm spss version 20 với mức xác suất có ý nghĩa p < 0,05, các biểu đồ số liệu được xây dựng bằng phần mềm Excel.
3. KẾT QUẢ
3.1. Cảm ứng tạo mô sẹo Dó vân nam và Dó quả nhăn
Trong thí nghiệm này, chất điều hòa sinh trưởng 2,4-D được sử dụng một cách riêng lẻ hoặc kết hợp với BAP hoặc TDZ để đánh giá khả năng cảm ứng mô sẹo của hai loài Dó vân nam và Dó quả nhăn từ mẫu lá in vitro. Kết quả cho thấy, tất cả các mẫu trong công thức đối chứng (không chứa chất điều hòa sinh trưởng) không có khả năng tạo mô sẹo, trong khi ở các công thức còn lại 100% số mẫu tạo mô sẹo. Mặt khác, một điểm chung giữa hai loài là ở các công thức sử dụng 2,4-D một cách riêng lẻ ở nồng độ 1 mg/L 2,4-D (khối lượng tươi mô sẹo đạt 311,02 mg ở Dó vân nam và 325,57 mg ở Dó quả nhăn sau 8 tuần cảm ứng) - hiệu quả tạo mô sẹo kém hơn các công thức có nồng độ cao hơn. Tuy nhiên, khi tăng lên 3-4 mg/L 2,4-D kết quả tạo mô sẹo lại không có nhiều khác biệt so với công thức 2 mg/L 2,4-D (đạt 360,97 mg ở Dó vân nam, 366,11 mg ở Dó quả nhăn). Điều này cho thấy nồng độ 2,4-D thấp hay cao quá đều cho hiệu quả tạo mô sẹo không cao và nồng độ 2,4-D thích hợp cho cảm ứng tạo mô sẹo từ lá Dó vân nam và Dó quả nhăn là từ 2-3 mg/L. Khi kết hợp giữa 2,4-D ở nồng độ 2 hoặc 3 mg/L với BAP từ 0,5-1,5 mg/L cho thấy ở cả hai loài tổ hợp 2 mg/L 2,4-D kết hợp với 0,5 mg/L BAP cho khả năng tạo mô sẹo cao nhất với 415,16 mg mô sẹo/mẫu lá ở Dó vân nam và 417,23 mg/mẫu lá ở Dó quả nhăn.
Tương tự, kết quả ghi nhận được ở các công thức 2,4-D (2 hoặc 3 mg/L) kết hợp lần lượt với TDZ khả năng tạo mô sẹo ở hai loài Dó đều tăng lên khi tăng nồng độ TDZ. Ở Dó vân nam tổ hợp 3 mg/L 2,4-D với 0,8 mg/L TDZ cho khả năng tạo mô sẹo tốt nhất (426,61 mg mô sẹo/mẫu lá) trong khi ở Dó quả nhăn ghi nhận hai tổ hợp 2 mg/L 2,4-D kết hợp 0,8 mg/L TDZ (cho 419,68 mg mô sẹo/mẫu lá) và 3 mg/L 2,4-D kết hợp với 0,8 mg/L TDZ (cho 429,28 mg mô sẹo/mẫu lá) (hình 01). Các tổ hợp này khi so với tổ hợp tốt nhất khi kết hợp với BAP đều cho kết quả tốt hơn.
Khi so sánh về đặc điểm hình thái của mô sẹo cho thấy: ở những công thức sử dụng đơn lẻ 2,4-D mô sẹo thu nhận được thường có màu hơi trắng và chắc hơn. Ở những công thức phối hợp chất điều hòa sinh trường ghi nhận mô sẹo màu kem và xốp hơn. Mô sẹo của loài Dó vân nam chắc hơn mô sẹo Dó quả nhăn. Như vậy, có thể khẳng định công thức thích hợp nhất để cảm ứng tạo mô sẹo với hai loài Dó vân nam và Dó quả nhăn 3 mg/L 2,4-D với 0,8 mg/L TDZ.
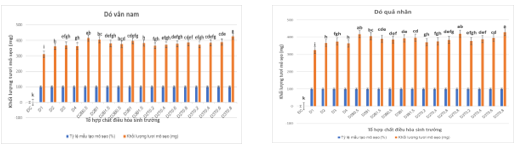
Hình 01. Kết quả tác động của chất điều hòa sinh trưởng lên khả năng cảm ứng mô sẹo Dó vân nam và Dó quả nhăn (ĐC: không chất điều hòa sinh trưởng; D1-D4: 2,4D 1-4 mg/L; D2B0,5 - D2B1,5: 2,4D 2mg/L+BAP 0,5-1,5mg/L; D2T0,2-D2T0,8: 2,4D 2mg/L+TDZ 0,2-0,8 mg/L

Hình 02. Mô sẹo trên các môi trường nuôi cấy khác nhau của Dó vân nam (a: ĐC; b: D3, c: D2B0,5; d: D2B1 và e: D3T0,8) và Dó quả nhăn (f: ĐC; g: D3; h: D2B0,5; i: D2T0,8 và k: D3T0,8); thước 1 cm.
3.2. Ảnh hưởng chất điều hòa sinh trưởng đến khả năng nhân nhanh mô sẹo
Sau khi tạo mô sẹo, việc nhân sinh khối mô sẹo để có nguồn mô sẹo tốt, đủ tiêu chuẩn và số lượng cho các thí nghiệm tiếp theo đóng vai trò hết sức quan trọng. Sự kết hợp của 2 hoặc 3 mg/L 2,4-D với 0,5-1,5 mg/L BAP hoặc 0,2-0,8 mg/L TDZ được dùng để đánh giá khả năng nhân nhanh mô sẹo hai loài Dó vân nam và Dó quả nhăn. Kết quả phân tích thống kê ở cả hai loài cho thấy có sự khác biệt rõ rệt giữa các công thức nghiên cứu. Ở loài Dó vân nam, trong nhóm công thức phối hợp giữa 2,4-D và BAP thì công thức 2 mg/L 2,4-D với 0,5 mg/L BAP (D2B0,5) cho kết quả tốt nhất với khối lượng mô sẹo tươi, mô sẹo khô và chỉ số GI lần lượt là 6,12 g/mẫu, 0,41 g và 3,10. Khi phối kết hợp giữa 2,4-D với TDZ cho thấy hai tổ hợp 2 hoặc 3 mg/L 2,4-D với 0,8 mg/L TDZ ở công thức D2T0,8 và D3T0,8 đều cho các chỉ số nghiên cứu cao vượt trội so với các tổ hợp còn lại và không có sự khác biệt có ý nghĩa giữa hai công thức này. Kết quả ghi nhận ở hai công thức là 6,61-6,77 g mô sẹo tươi/mẫu; 0,44-0,47 g mô sẹo khô/mẫu và chỉ số tăng trưởng 3,41-3,51 (Hình 03). Tuy nhiên, các khối mô sẹo nhận được của loài Dó vân nam tương đối là chắc.
Đối với loài Dó quả nhăn, công thức D2B0,5 (2 mg/L 2,4-D và 0,5 mg/L BAP) cho kết quả nhân sinh khối mô sẹo tốt nhất đạt 6,43 g mô sẹo tươi/mẫu, 0,41 g mô sẹo khô/mẫu và chỉ số GI là 3,1 so với nhóm kết hợp giữa 2,4-D và BAP (D2B0,5-D3B1,5). Trong khi ở các công thức có sự phối hợp giữa 2,4-D và TDZ cho thấy: khi giữ cố định nồng độ 2,4-D tăng dần TDZ từ 0,2-0,8 mg/L thì khả năng sinh trưởng của mô sẹo tăng lên. Trong đó, công thức cho kết quả tốt nhất là D2T0,6 (2 mg/L 2,4-D kết hợp với 0,6 mg/L TDZ) với các chỉ số thu nhận là 7,21 g mô sẹo tươi/mẫu, 0,45 g mô sẹo khô/mẫu và chỉ số GI là 3,81. Công thức bổ sung 0,8 mg/L TDZ có kết quả giảm đi so với ở công thức TDZ 0,6 mg/L. Ở các công thức cố định nồng độ 2,4 -D ở mức 3 mg/L cho kết quả về các chỉ số nghiên cứu đều thấp hơn ở các công thức có nồng độ TDZ tương ứng khi kết hợp với 2 mg/L 2,4-D.
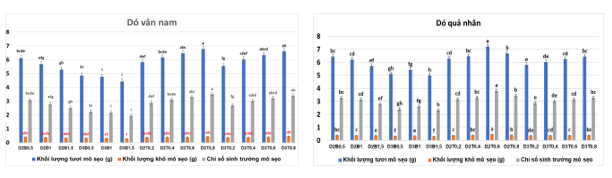
Hình 03. Kết quả tác động của chất điều hòa sinh trưởng lên sự nhân nhanh mô sẹo Dó vân nam và Dó quả nhăn (D2B0,5-D2B1,5: 2,4D 2mg/L+BAP 0,5-1,5mg/L; D2T0,2-D2T0,8: 2,4D 2mg/L+TDZ 0,2-0,8 mg/L; D3T0,2-D3T0,8: 2,4D 3mg/L+TDZ 0,2-0,8 mg/L)
3.3. Ảnh hưởng của chất điều hòa sinh trưởng đến huyền phù tế bào
Mô sẹo được nhân duy trì trong môi trường MS có chứa 2 mg/L 2,4-D + 0,8 mg/LTDZ qua một số chu kỳ trở nên xốp (Hình 04) được dùng làm nguyên liệu cho thí nghiệm tạo huyền phù tế bào. Ở thí nghiệm này, sự tổ hợp của 2 mg/L mỗi loại 2,4-D, IBA, NAA và IAA với 0,8 mg/L TDZ.

Hình 04. Mô sẹo Dó vân nam (A, mũi tên) và Dó quả nhăn (B, mũi tên) làm nguyên liệu tạo huyền phù tế bào
Bảng 01. Kết quả ảnh hưởng của sự kết hợp giữa 2,4D, IAA, IBA và NAA với TDZ đến khả năng tạo huyền phù Dó vân nam và Dó quả nhăn
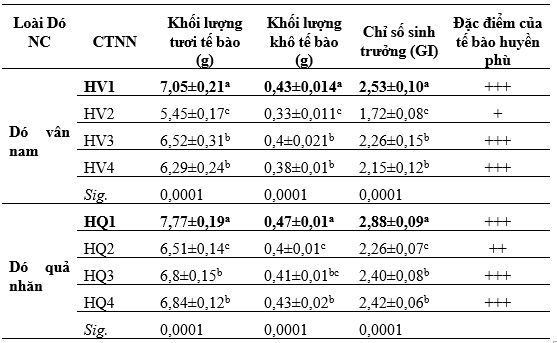
Ghi chú: Các giá trị trong bảng là mean ± SD; Trong cùng một cột, các chữ cái khác nhau biểu thị sự sai khác về mặt thống kê có ý nghĩa ở mức xác suất 95%.(HV1, HQ1: 2 mg/L 2,4-D+0,8 mg/L TDZ; HV2, HQ2: 2 mg/L IAA+0,8 mg/L TDZ; HV3, HQ3: 2 mg/L IBA+0,8 mg/L TDZ; HV4, HQ4: 2 mg/L NAA+0,8 mg/L TDZ; +++ Huyền phù tế bào màu kem, ++ huyền phù tế bào màu trắng, + huyền phù màu hơi nâu)
Kết quả phân tích số liệu cho thấy ở cả hai loài Dó vân nam và Dó quả nhăn, kết quả của các công thức thí nghiệm đều thể hiện có sự khác biệt nhau rõ rệt. Điều này cho thấy các loại auxin được sử dụng trong thí nghiệm này có ảnh hưởng khác nhau lên khả năng sinh trưởng của huyền phù tế bào hai loài Dó. Cụ thể: Công thức tốt nhất đối với cả hai loài là sự kết hợp giữa 2 mg/L 2,4-D với 0,8 mg/L TDZ với các chỉ số khối lượng mô sẹo tươi, mô sẹo khô và chỉ số GI lần lượt là 7,05 g, 0,43 g, 2,53 ở Dó vân nam và 7,77 g, 0,47 g và 2,88 ở Dó quả nhăn. Hai tổ hợp IBA và NAA kết hợp với TDZ có kết quả tương đương nhau ở cả hai loài. Trong khi, sự kết hợp giữa IAA với TDZ tỏ ra kém hiệu quả nhất đối với sự tăng trưởng của huyền phù tế bào của cả hai loài Dó nghiên cứu.

Hình 05. Huyền phù tế bào Dó vân nam và Dó quả nhăn trong các môi trường chứa chất điều hòa sinh trưởng khác nhau, thước 1 cm
3.4. Ảnh hưởng của glucose và sucrose đến huyền phù tế bào
Trong nghiên cứu này, hai loại đường glucose và sucrose được sử dụng một cách riêng lẻ và kết hợp để đánh giá mức độ tác động lên khả năng tăng trưởng của huyền phù tế bào hai loài Dó nghiên cứu.
Ở loài Dó vân nam, khi sử dụng glucose hoặc sucrose riêng lẻ từ 30-50 g/Lđều ghi nhận kết quả ở công thức có chứa 30 g/L hai loại đường này khối lượng mô sẹo tươi, khô và chỉ số GI đều thấp hơn ở hai công thức chứa 40 và 50 g/L. Tuy nhiên, giữa hai công thức 40 và 50 g/L của cả hai loại đường lại không có sự khác biệt đáng kể. Ở các công thức phối hợp hai loại đường glucose và sucrose với tổng hai loại đạt 30 g/L (20S10G và 10S20G) thu nhận kết quả cao hơn so với hai công thức 30 g/L của mỗi loại đường. Khi tăng hàm lượng đường trong các tổ hợp từ 30S10G-30S20G, kết quả ở các tiêu chí nghiên cứu đều tăng lên. Điều này cho thấy, sự kết hợp hai loại đường glucose và sucrose là thích hợp cho nuôi cấy huyền phù tế bào. Trong đó, công thức 20S20G cho kết quả ở ba chỉ tiêu theo dõi tương đương với 30S20G và 20S30G. Như vậy, xét nhiều góc độ cho thấy công thức gồm 20 g/L sucrose và 20 g/L glucose là thích hợp cho sự tăng trưởng của huyền phù tế bào loài Dó vân nam với các chỉ số nghiên cứu: khối lượng tươi tế bào, khối lượng khô và chỉ số sinh trưởng của tế bào lần lượt là 7,99 g, 0,46 g và 3,0.
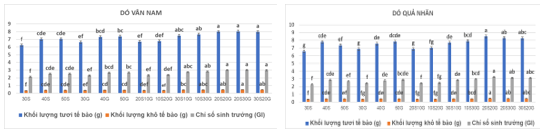
Hình 06. Kết quả tác động của các loại đường lên khả năng sinh trưởng của huyền phù tế bào Dó vân nam và Dó quả nhăn (S=sucrose, G = glucose)
Tương tự, ở loài Dó quả nhăn kết quả được phân tích trong Bảng 3.7 cho thấy giữa các công thức nghiên cứu có ảnh hưởng khác biệt nhau rõ rệt lên khả năng sinh trưởng của huyền phù tế bào Dó quả nhăn. Kết quả sử dụng đơn lẻ hai loại đường cho thấy công thức 40 g/L glucose hoặc sucrose là phù hợp. Sự kết hợp hai loại đường trên cũng ghi nhận sự tăng trưởng vượt lên của huyền phù tế bào và công thức 20S20G (20 g/L glucose và 20 g/L sucrose) cho kết quả tốt nhất (8,51 g sinh khối tươi tế bào, 0,49 g sinh khối khô và chỉ số tăng trưởng tế bào 3,25). Như vậy, ở cả hai loài Dó quả nhăn và Dó vân nam sự sinh trưởng của huyền phù tế bào đạt hiệu quả cao nhất ở sự kết hợp hai loại đường sucrose và glucose với hàm lượng 20 g/L mỗi loại.

Hình 07. Huyền phù tế bào ở các môi trường có chứa lượng đường khác nhau (Dó vân nam: A (30S), B (20S20G); Dó quả nhăn: C (20S20G), D (20S30G)); thước 1 cm
4. THẢO LUẬN
2,4-D là chất điều hòa sinh trưởng được sử dụng khá phổ biến trong tạo mô sẹo ở các loài thực vật nói chung và các loài chi Aquilaria nói riêng [2, 11, 16, và 17]. Nghiên cứu trước đó chỉ ra rằng, mô sẹo A. agallocha được hình thành tốt nhất trong môi trường có bổ sung 4 mg/L 2,4-D [2] hay 9 µM 2,4-D ở loài A. malaccensis [13]. Trong nghiên cứu này, 3 mg/L 2,4-D là thích hợp cho tạo mô sẹo Dó vân nam và Dó quả nhăn. Sự kết hợp giữa 2,4-D với BAP đã cho thấy hiệu quả tạo mô sẹo tốt hơn so với 2,4-D riêng lẻ ở một số loài Aquilaria: 4 mg/L 2,4-D kết hợp 0,5 mg/L BAP mang lại hiệu quả tốt cho tạo mô sẹo A. malaccensis[17] và A. beccariana [22] hay 22,6 µM 2,4-D kết hợp với 4,4 µM BAP. Ảnh hưởng của TDZ phối hợp với 2,4-D lên khả năng cảm ứng mô sẹo Aquilaria còn khá hạn chế. Nghiên cứu này đã ghi nhận 2 mg/L 2,4-D kết hợp với 0,5 mg/L BAP cho kết quả tạo mô sẹo tốt ở cả hai loài với khối lượng tươi mô sẹo thu nhận được sau 8 tuần nuôi cấy là 415,16 mg ở Dó vân nam và 417,23 mg ở Dó quả nhăn. Khi kết hợp giữa 2,4-D với TDZ, cho thấy 3 mg/L 2,4-D cùng 0,8 mg/L TDZ cho hiệu quả tạo mô sẹo tốt nhất với 426,61 mg và 429,28 mg mô sẹo tươi lần lượt ở Dó vân nam và Dó quả nhăn.
Sau cảm ứng, mô sẹo cần được nuôi cấy để tạo sinh khối và chất lượng mô sẹo tốt làm nguyên liệu cho nghiên cứu tiếp theo. Những nghiên cứu trước đó cho thấy, các loài Aquilaria khác nhau có thể thích hợp với những môi trường tạo mô sẹo khác nhau: Nguyen Thi Tho et al. (2021) sử dụng môi trường cảm ứng mô sẹo tối ưu là 2 mg/L IBA kết hợp 1 mg/L BAP để nhân nuôi mô sẹo loài Dó quả nhăn [5], ở loài A. agallocha mô sẹo sinh trưởng tốt trong môi trường có bổ sung 2 mg/L 2,4-D và 0,5 mg/L BAP [2], mô sẹo có nguồn gốc từ lá loài A. malaccensis được nhân nuôi tốt phục vụ làm vật liệu nuôi cấy huyền phù trong môi trường có chứa 2,3 μM 2,4-D và 2,2 μM BAP [13]. Nghiên cứu này ghi nhận, mô sẹo loài Dó vân nam được nhân nuôi thích hợp nhất trong môi trường MS có bổ sung 2 mg/L 2,4-D kết hợp với 0,8 mg/L TDZ và Dó quả nhăn là MS có chứa 2 mg/L 2,4-D kết hợp với 0,6 mg/L TDZ.
Các loại auxin khác nhau có thể có những tác động khác nhau lên quá trình nuôi cấy huyền phù tế bào thực vật nói chung và Aquilaria nói riêng. Ở loài A. beccariana [22] huyền phù tế bào được nuôi cấy thành công trong môi trường có bổ sung 3 mg/L NAA + 0,5 mg/L BAP. Môi trường có bổ sung 2 mg/L NAA + 1 mg/L BA là môi trường thích hợp nhất cho huyền phù tế bào loài A. sinensis [21]. Huyền phù tế bào Dó quả nhăn được thiết lập thành công trong môi trường có bổ sung 2 mg/L IBA + 1 mg/L BAP [5]. Tuy nhiên, chưa có báo cáo trước đó về ảnh hưởng của các loại auxin kết hợp với TDZ lên sự nuôi cấy huyền phù tế bào các loài Aquilaria. Kết quả của nghiên cứu này cho thấy cả 4 loại auxin (2,4-D, IAA, IBA và NAA) ở nồng độ 2 mg/L kết hợp với 0,8 mg/L TDZ đều có hiệu quả đối với huyền phù tế bào hai loài Dó vân nam và Dó quả nhăn. Tuy nhiên, kết quả tốt nhất được ghi nhận ở tổ hợp chất điều hòa sinh trưởng 2 mg/L 2,4-D với 0,8 mg/L TDZ.
Trong nuôi cấy mô tế bào thực vật, đường là nguồn cung cấp cacbon cho tế bào. Sucrose là loại đường được sử dụng rộng rãi với hàm lượng từ 20-50 g/L [25]. Cùng với sucrose, glucose cũng đã được thử nghiệm trong nuôi cấy huyền phù tế bào một số loài Aquilaria: Mô sẹo loài A. malaccensis sinh trưởng tốt nhất ở môi trường có chứa 3 mg/L NAA, 0,5 mg/L BAP và 40 g/L sucrose [16]; môi trường có chứa 40 g/L sucrose được ghi nhận tốt nhất cho sự sinh trưởng của tế bào huyền phù loài A. malaccensis [14], A. beccariana [22]; Shashita et al (2014) đã thử nghiệm 3 loại đường sucrose, glucose và frucrose ở nồng độ từ 15-30 g/L trên loài A. malaccensis cho kết quả 15 g/L sucrose là thích hợp nhất [18]. Đối với hai loài Dó vân nam và Dó quả nhăn trong nghiên cứu này, 40 g/L sucrose hoặc 40 g/L glucose riêng lẻ là thích hợp cho tăng trưởng tế bào huyền phù của cả hai loài sinh trưởng, phát triển và đặc biệt khi phối kết hợp hai loại đường đã ghi nhận 20 g/L sucrose cùng với 20 g/L glucose là tốt nhất ở cả hai loài Dó nghiên cứu.
5. KẾT LUẬN
Mô sẹo từ lá hai loài Dó vân nam và Dó quả nhăn được cảm ứng thành công trên môi trường MS có bổ 2,4-D riêng lẻ hoặc kết hợp với BAP hoặc TDZ. Trong đó, tổ hợp chất điều hòa sinh trưởng hiệu quả nhất cho tạo mô sẹo ở cả hai loài là 3 mg/L 2,4-D + 0,8 mg/L TDZ. Mô sẹo được cấy chuyển và nhân sinh khối thành công trên môi trường có chứa 2 mg/L 2,4-D + 0,8 mg/L TDZ với loài Dó vân nam và 2 mg/L 2,4-D + 0,6 mg/L TDZ với loài Dó quả nhăn. Môi trường có chứa 2 mg/L 2,4-D + 0,8 mg/L TDZ + 20 g/L sucrose và 20 g/L glucose là thích hợp cho sự tăng sinh của huyền phù tế bào của cả hai loài Dó vân nam và Dó quả nhăn.
Lời cảm ơn: Nhóm tác giả xin trân trọng cảm ơn sự tài trợ kinh phí từ Bộ Khoa học và Công nghệ (nhiệm vụ: NVQG-2022/ĐT.11) cho nghiên cứu này. Chúng tôi xin cảm ơn sự hỗ trợ từ Viện Công nghệ sinh học Lâm nghiệp, Trường Đại học Lâm nghiệp.
Tuyên bố về đóng góp của tác giả: Hoàng Thị Hằng: Thu thập mẫu vật, thiết kế, bố trí thí nghiệm; Phùng Thị Tuyến: Thu thập mẫu vật; Nguyễn Thành Tuấn: Thu thập mẫu vật; Khuất Thị Hải Ninh: Bố trí thí nghiệm, thu thập số liệu; Nguyễn Thế Nhã: góp ý, chỉnh sửa bản thảo bài báo Nguyễn Thị Thơ: bố trí thí nghiệm, xử lý số liệu, chuẩn bị bản thảo gốc.
Tuyên bố về xung đột lợi ích: Nhóm tác giả không có sự xung đột về lợi ích. Nghiên cứu được tài trợ bởi Bộ Khoa học và Công nghệ trong nhiệm vụ: NVQG- 2022/ĐT.11.
Tài liệu tham khảo
2 B. Debnath, In vitro response, growth and maintenance of callus of Aquilaria agallocha Roxb. (Thymelaeaceae), Bioscience Discovery, Vol. 4, No. 2, pp. 155-159, 2013.
3 Hoang Van Sam et al., Aquilaria yunnanensis S.C. Huang (Thymelaeaceae), A New Record for the Flora of Vietnam, Forest and Society, Vol. 3, No. 2, pp. 202-208, 2019.
4 Le Cong Kiet, Paul J. A. Kessler and M. Eurlings, A new species of Aquilaria (Thymelaeaceae) from Vietnam, Blumea, Vol. 50, pp. 135-141, 2005. DOI: 10.3767/000651905X623319
5 Nguyen Thi Tho et al., Establishment of callus and cell suspension of Aquilaria rugosa L.C. Kiet and Keβler in Vietnam, Asian Journal of Plant Sciences, Vol. 20, No. 1, pp. 163-171, 2021.
6 N. Putri, L. Karlinasari, M. Turjaman, I. Wahyudi and D. Nandika, Evaluation of incense-resinous wood formation in agarwood (Aquilaria malaccensis Lam.) using sonic tomography, Agriculture and Natural Resources, Vol. 51, No. 2, pp. 84-90, 2017. DOI: 10.1016/j.anres.2016.08.009
7 S. Akter, M. T. Islam, M. Zulkefeli and S. I. Khan, Agarwood production-a multidisciplinary field to be explored in Bangladesh, International Journal of Pharmaceutical and Life Sciences, Vol. 2, No. 1, pp. 22-32, 2013.
8 Y. Z. H.-Y. Hashim, N. I. Ismail and P. Abbas, Analysis of chemical compounds of agarwood oil from different species by gas chromatography mass spectrometry (GCMS), IIUM Engineering Journal, Vol. 15, No. 1, pp. 55-60, 2014.
9 A. Namdeo, Plant cell elicitation for production of secondary metabolites: a review, Pharmacogn Rev, Vol. 1, No. 1, pp. 69-79, 2007.
10 A. Filová, Production of secondary metabolities in plant tissue cultures, Research Journal of Agricultural Science, Vol. 46, No. 1, 2014.
11 Yukie Okudera, M. Ito, Production of agarwood fragrant constituents in Aquilaria calli and cell suspension cultures, Plant Biotechnology, Vol. 26, pp. 307-315, 2009. DOI: 10.5511/plantbiotechnology.26.307
12 S. Gürel, E. Gürel And Z. Kaya, Establishment of cell suspension cultures and plant regeneration in sugar beet (Beta vulgaris L.), Turkish Journal of Botany, Vol. 26, No. 4, pp. 197-206, 2002.
13 S. J. C. S. Hoon, In vitro cultures of Aquilaria malaccensis for agarwood production, Doctor of Philosophy, School of Biosciences, University of Nottingham, 2014.
14 S. Z. B. M. R. Jamil, Cell suspension culture of Aquilaria malaccensis Lamk., Bachelor Plant Science and Environmental Ecology. Universiti Malaysia Sarawak, Universiti Malaysia Sarawak, 2013.
15 M. S. Mohamad Hamdan, A. W. Aminan, S. H. N. Shaarani and S. N. Tajuddin, Characterization of Aquilaria malaccensis callus cells using SEM and somatic embryogenesis associated genes identification, presented at the 2nd International Conference on Tropical Resources and Sustainable Sciences, Malaysia, 2020.
16 M. Saikia, K. Shrivastava, and S. S. Singh, An efficient protocol for callus induction in Aquilaria malaccensis Lam. Using leaf explants at varied concentrations of sucrose, International Journal of Plant Research, Vol. 2, No. 6, pp. 188-194, 2012.
17 N. Noordin, R. Ibrahim, N. Khalid and N. A. Rahman., Establishment of Aquilaria malaccensis callus, cell suspension and adventitious root systems in Research and Development Seminar 2010, Bangi (Malaysia), 2010, pp. RnD10-1244.
18 S. Jayaraman, N. H. Daud, R. Halis and R. Mohamed, Effects of plant growth regulators, carbon sources and pH values on callus induction in Aquilaria malaccensis leaf explants and characteristics of the resultant calli, Journal of Forestry Research, Vol. 25, No. 3, p. 535-540, 2014. DOI: 10.1007/s11676-014-0492-8
19 Q. S. Yuan, Aquilaria Species: In vitro culture and the productioii'of Eaglewood (Agarwood) in Biotechnology in Agriculture and Forestry 33, Vol. 33 (Medicinal and Aromatic Plants VIII), Y. Bajaj, editor. Springer-Verlag Berlin Heidelberg GmbH, 1995, pp. 36-46.
20 Zhikai Wang et al., Research on using Aquilaria sinensis callus to evaluate the agarwood-inducing potential of fungi, Plos One, Vol. 19, No. 12, pp. 1-15, 2024. DOI: 10.1371/journal.pone.0316178
21 Juan Liu et al., Establishment of a cell suspension culture system of endangered Aquilaria sinensis (Lour.) Gilg, National Library of Medicine, Vol. 49, No. 8, pp. 1194-1199, 2014.
22 K. B. Ab.Aziz, Suspension culture of Aquilaria beccariana Van Teigh, Barchelor. Department of Plant Science and Environmental Ecology, Universiti Malaysia Sarawak, 2013.
23 DLC Kumari Fonseka, M Abeygunawardana and T. Ishara, Callus production and resin induction of Agarwood (Aquilaria crassna) in International Symposium on Agriculture and Environment. Sri Lanka, University of Ruhuna, 2017, pp. 39-42.
24 R. B. Junaidi, Establishment of callus culture of Aquilaria microcarpa Baill. Universiti Malaysia Sarawak, 2012.
25 R. H. Smith, Media components and preparation, Callus induction. In: Plant Tissue Culture (Techniques and Experiments). Cambridge, Elsevier Academic Press, 2013, p. 190.